Força de Adesão da água

Definição de Adesão
Na química, a “adesão” refere-se à tendência de algumas substâncias se apegar a outras substâncias. Ele vem das palavras de raiz “ad” para “outros” e “hesion” para “aderir”. A adesão geralmente é causada por interações entre as moléculas das duas substâncias. A substância adesiva mais importante na Terra é a água.
As moléculas de água são altamente polares, o que significa que uma parte da molécula tem uma ligeira carga negativa, enquanto a outra tem uma ligeira carga positiva.
Isso ocorre porque o núcleo do átomo de oxigênio da água atrai os elétrons da molécula mais forte do que os núcleos de seus átomos de hidrogênio. Como resultado, o átomo de oxigênio é carregado ligeiramente negativamente, enquanto os hidrogênios são ligeiramente carregados positivamente.
Na imagem acima, o símbolo “δ” indica uma carga parcial devido ao compartilhamento de elétrons desigual.
Isso permite que a água interaja fortemente com outras substâncias carregadas ou polares. Como os átomos de acusações opostas são atraídos um ao outro, diferentes partes de moléculas de água são atraídas tanto para íons e moléculas positivas quanto negativas.
Em larga escala, isso significa que a água irá manter muitas substâncias.
As moléculas de água também se mantêm umas às outras pelo mesmo motivo, porque todas as moléculas de água são polares. Esta propriedade, denominada “coesão”, funciona com adesão para possibilitar algumas funções de vida.
Exemplos de adesão
Exemplos n. ° 1: ação capilar
Você já viu ação capilar se você já mergulhou a borda de uma toalha de papel ou papel higiênico em uma poça de água.
Você notará que a água corre até a toalha de papel com bastante rapidez, eventualmente imergindo o todo, mesmo que você tenha mergulhado apenas um canto no líquido!
Essa é a adesão da água em ação: as moléculas de água aderem às moléculas carregadas dentro do papel.
Para torná-los absorventes, as toalhas de papel e o papel higiênico são especialmente feitos com canais estreitos que incentivam a água a “escalar” até que saem dos canais para preencher.
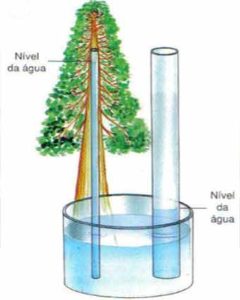
Este é o mesmo mecanismo que permite que as árvores dessem água e minerais do solo para nutrir suas folhas. As árvores são feitas dos mesmos materiais que o papel (ou melhor, o papel é feito de árvores), e as árvores têm canais minúsculos dentro deles que sugam água da mesma maneira que uma toalha de papel.
Se a água não fosse polar e não tivesse propriedade de adesão, as árvores que as conhecemos não poderiam existir!
Exemplos # 2: Solutos dissolvendo
A tendência das moléculas de água para manter outras moléculas também permite que a água dissolva substâncias importantes para a vida, tais como íons, DNA e muitas proteínas.
Isso é necessário para a vida porque as moléculas que foram dissolvidas em água ou outro solvente polar interagem uns com os outros mais prontamente. Então, a polaridade da água também faz reações químicas importantes para a vida!
Termos de Biologia Relacionados
- Ação capilar– O mecanismo pelo qual as árvores extraem água através de suas raízes para alimentar suas folhas.
- Coesão– A tendência das moléculas de manter outras moléculas como elas mesmas.
- Polaridade– Uma propriedade de algumas moléculas onde uma parte da molécula tem uma ligeira carga positiva, enquanto outra tem uma ligeira carga negativa.


